共计 4140 个字符,预计需要花费 11 分钟才能阅读完成。
荧光蛋白的发现和后续优化中的遗传性质的这些显着的探针来生成各种各样的发射带宽配置已扩展生物学家在活细胞中具有高时空分辨率的可视化,跟踪和量化分子事件的能力。荧光蛋白可以融合到几乎任何感兴趣的蛋白质或酶,礁珊瑚,水母和海葵物种的各种来自以分析在活细胞中蛋白质地理,运动,血统,和生物化学。在此方面,这些生物探针提供了一个重要的新的方法来了解蛋白质的功能,这是一个合乎逻辑的步骤细胞过程的调查,现在许多生物体的基因组序列已被确定。
然而,由于已被用作荧光蛋白的亚细胞目标和在活细胞中的基因产物的功能特性进行调查,许多设计的应用程序,以确定蛋白的周转率或时间的表达模式的分析几乎是不可能的,由于与传统的荧光蛋白的事实,即它们连续地被回收(合成,折叠,和随后的退化)在细胞内的。其结果是,一个大合奏的蛋白质在其一生中的不同阶段被观察在任何特定时刻与传统的荧光蛋白,表现出稳定的发射光谱的档案。
表征蛋白质表达时间或终身的一个简单的方法是利用不稳定的荧光蛋白的变种,可以很容易地通过荧光强度区分。因此,嵌合荧光蛋白是通过蛋白水解迅速上交可划分为类较年轻的,新合成的荧光分子,已经失去了他们的发色基团的降解,由于荧光的老蛋白嵌合体。不幸的是,迅速衰减的荧光结果在非常低的信号水平,呈现准确地监测蛋白质动力学,并获得合适的数字图像之间的一种折衷。
一个更有效的解决方案是采用荧光蛋白的光谱特性随时间的变化,光照波长或类似的研究者可以控制的变量。这个类中进行探测的第一和最基本的例子之一是 产生的随机诱变的红色发光的珊瑚礁来自 Discosoma 芨(第一指定作为突变drFP583,但现在通常被称为 荧光蛋白的 荧光 计时器 蛋白 DsRed 的)。 最初,定时器蛋白产生的绿色发光的荧光基团(峰值在 500 纳米,类似于绿色荧光蛋白),但超过几个小时内,慢慢地转换的荧光,在黄 - 红光谱区域发射一个物种(和最多在 580 纳米)。与定时器部分的嵌合融合蛋白的前进年龄可确定由持续下降,所观察到的比绿色到红色荧光。然后,这个比率可以被用来收集用于基因表达的时空数据调查。
代表也许是最有前途的方法 ,可以激活从静止状态(这个过程被称为 光活化 ),或 启动荧光蛋白生色 能够被光转换荧光发射带宽从一个到另一个(光电转换 ), 体内 蛋白质的寿命,运输和周转率的调查。适当称为 分子 或光荧光笔 ,一般很少或根本没有显示的光活化荧光蛋白成像波长的激发下初始荧光,但显着提高其荧光强度照射激活后,在不同的波长(通常较低)。 光转化光学荧光笔,另一方面,经过时光学变化的生色团的荧光发射带宽配置的变化。这些影响导致的直接和受控的高亮显示的不同的分子在细胞内池。因为只有有限人口的光敏分子表现出明显的荧光,其寿命和行为独立的新合成的蛋白质,可以遵循。在类似的方式中,荧光蛋白,其能够是光调制的光转化通过可逆地改变发光强度和 / 或颜色也可能是非常有用的研究在活细胞中的动态过程。
图 1 中显示出一个卡通发展到今天为止(在下面更详细讨论)是最有用的光学荧光笔光转化的机制。激活或转换序列为每个荧光笔在单个列概述,较单个细胞含有一个中央核序列中的每一步都被雇用重复卡通绘图。高强度的照明大闪电,而低强度照明为代表的小螺栓。的荧光的激发波长是闪电的颜色相似,而发光颜色出现在细胞核和 / 或细胞质中的细胞动画片。要检查的顺序,最上面画的细胞开始,并继续向下列。例如,一个单一的单元格包含光活化的绿色荧光蛋白(PA-GFP ; 下面描述)示出转换前的第一列的顶部,并且非荧光显示(灰度)。(三)光照后的 405 纳米的光(紫色闪电,图 1(b))中的核,具有绿色荧光,慢慢地扩散到细胞质中,所示的较低的两个细胞动画片(PA-GFP 蛋白的及(d)),在第一列中。其它列包含序列象征光学荧光笔在随后的章节中讨论的光转化机制。
发现光荧光笔
早期的努力产生一个有用的光可活化荧光蛋白会见了相对温和的成功。光学荧光笔第一调查集中在野生型绿色荧光蛋白(GFP),来自水母 Aequorea victoria 的,主要在 395 至 400 纳米为中心的和最多的紫外光谱区的吸收。 成离子酚物种吸收强烈,最高在 483 纳米,400 纳米区域中的蛋白质与紫色光照明将中性酚醛生色。光转化反应介导的谷氨酸残基的荧光蛋白质主链中的位置 222 中的脱羧作用。经过激烈的紫光灯照射,可激发产生的绿色荧光,在 395 和 488 纳米的相对强度监测,跟踪光活化的野生型 GFP,尽管有一些限制。首先,虽然定量的原则,的双重激励技术,不容易使用大多数激光扫描共聚焦显微镜进行。第二个缺点是光活化的野生型绿色荧光蛋白只产生荧光信号强度增加了三倍。最后,使用近紫外光激发损害最活细胞(尤其是照射时,核区),并在图像采集过程持续光敏引发了一个问题。
的绿色荧光蛋白在厌氧条件下,以一个物种,发射橙红色区域的波长(590-600 纳米)的光转化是潜在有用的,在低的氧环境中的细菌和酵母的调查,但在培养的哺乳动物的研究中提供的小工具细胞。从绿色到红色的荧光发射的过渡时,会发生氧不足型绿色荧光蛋白(分离或内完好生物体)与蓝色的电弧放电灯或激光源的光的相对低剂量的照射。用紫外光光激活的绿色荧光蛋白,绿色荧光蛋白在缺氧的情况下所产生的蓝色照明的红色荧光强度相对较低。此外,效果减弱后迅速返回到正常有氧条件。
光学荧光笔的属性
| 荧光 蛋白 (缩写色) |
励磁 最大 (NM) |
排放 最大 (NM) |
摩尔 消光 系数 |
量子 产量 |
在体内的 分子 结构 |
相对 亮度 (EGFP%) |
pKa 值 |
|---|---|---|---|---|---|---|---|
| PA-GFP(G / NA) | 400 | 515 | 20,700 | 0.13 | 单体 | 8 | 4.5 |
| PA-GFP(G) | 504 | 517 | 17,400 | 0.79 | 单体 | 41 | – |
| PS-CFP(C) | 402 | 468 | 34,000 | 0.16 | 单体 | 16 | 4.0 |
| PS-CFP(G) | 490 | 511 | 27,000 | 0.19 | 单体 | 15 | 6 |
| PS-CFP2(C) | 400 | 468 | 43,000 | 0.20 | 单体 | 26 | 4.3 |
| PS-CFP2(G) | 490 | 511 | 47,000 | 0.23 | 单体 | 32 | 6.1 |
| PA-mRFP1(R) | 578 | 605 | 10,000 | 0.08 | 单体 | 3 | 4.4 |
| Kaede(G) | 508 | 518 | 98,800 | 0.88 | 四聚体 | 259 | 5.6 |
| Kaede(R) | 572 | 580 | 60,400 | 0.33 | 四聚体 | 59 | 5.6 |
| Kikume(KikGR D&G) | 507 | 517 | 53,700 | 0.70 | 四聚体 | 112 | 7.8 |
| Kikume(KikGR R) | 583 | 593 | 35,100 | 0.65 | 四聚体 | 68 | 5.5 |
| wtEosFP(G) | 506 | 516 | 72,000 | 0.70 | 四聚体 | 150 | – |
| wtEosFP(R) | 571 | 581 | 41,000 | 0.55 | 四聚体 | 67 | – |
| dEosFP(G) | 506 | 516 | 84,000 | 0.66 | 二聚体 | 165 | – |
| dEosFP(R) | 569 | 581 | 33,000 | 0.60 | 二聚体 | 59 | – |
| tdEosFP(G) | 506 | 516 | 84,000 | 0.66 | 单体 | 165 | – |
| tdEosFP(R) | 569 | 581 | 33,000 | 0.60 | 单体 | 59 | – |
| mEosFP(G) | 505 | 516 | 67,200 | 0.64 | 单体 | 128 | 5.5 |
| mEosFP(R) | 569 | 581 | 37,000 | 0.62 | 单体 | 68 | 5.5 |
| Dendra(G) | 488 | 505 | 21,000 | 0.70 | 单体 | 44 | 6.6 |
| Dendra(R) | 556 | 575 | 20,000 | 0.72 | 单体 | 43 | 6.9 |
| Dendra2(G) | 490 | 507 | 45,000 | 0.50 | 单体 | 67 | 6.6 |
| Dendra2(R) | 553 | 573 | 35,000 | 0.55 | 单体 | 57 | 6.9 |
| Kindling(R) | 580 | 600 | 59,000 | 0.07 | 四聚体 | 12 | – |
| Dronpa(G) | 503 | 518 | 95,000 | 0.85 | 单体 | 240 | 5.0 |
表 1
旨在探讨使用红色荧光蛋白和一些衍生工具,多光子成像光学荧光笔在实验过程中,调查人员发现,暴露在波长小于 760 纳米的飞秒脉冲激光照射转移珊瑚礁从红色到绿色荧光蛋白的发光颜色。这种过渡的机制被认为是链接到 内发生的蛋白质的四聚体,由于从成熟形式的蛋白质的红色发射光漂白 的荧光共振能量转移(FRET)的减少 ,从而提高绿色发射,从不成熟的物种。 简称为 绿化的 效果,这种现象似乎很复杂依赖于成熟 DsRed 的效率。多光子激发的一个优点是专门 DsRed 的体积内选定的区域(体素)的光转化本地化的能力,但该方法需要专业和昂贵的设备(飞秒钛蓝宝石激光),许多实验室提供。此外,珊瑚礁的蛋白质(包括红色荧光蛋白)的倾向预留形成的四聚体 在体内 常常会影响这些探针的能力,参与生物功能的嵌合体的形成。
<55tr.com>page
在漂白后荧光恢复(FRAP)和荧光漂白损失(FLIP),目标选择性地漂白熄灭从一个荧光基团的荧光作为一个参考标签,同时使其他的两个不同的荧光蛋白融合的嵌合蛋白质 有关的技术 。 称为荧光漂白后(FLAP)的本地化 ,方法是由于它能够选择性地跟踪熔融嵌合荧光蛋白在活细胞中的光敏相媲美。 使用 β - 肌动蛋白的 融合构建 具有增强的黄色和青色荧光蛋白,同时跟踪贴壁的成纤维细胞中的快速重定位动态的单体(球状)G- 肌动蛋白和丝状 F - 肌动蛋白的慢得多的动态 进行了试验性研究 。 这种技术有望用于许多应用中,但需要几乎相同的表达水平在共转染的细胞中,各嵌合体的缺点是可能会复杂生物复杂的调查。
上面描述的方法可以成功地应用在某些情况下,蛋白质利用荧光蛋白跟踪和动态调查。然而,每种技术具有很大的局限性,妨碍了它的广泛应用监测许多活细胞中的处理所必需的基本研究。具体来说,这些光学荧光笔限制其恶劣的荧光强度和不稳定的光转换产品。进一步的限制,简单,高效,和具体的照明技术,光转化的蛋白质无法强制执行。
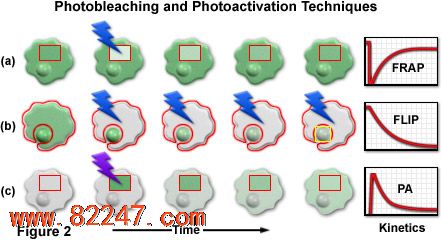
了理想的光学荧光笔蛋白应该是容易地 photoconvertible(通过荧光激活和 / 或发射波长位移的过程中)产生一个高的对比度水平,以及在目标系统中的最佳表达的单体。在实验中得到的结果与光漂白技术,如 光漂白 恢复(FRAP)和损失(FLIP)并联,这些探针将是特别有用的 ,因为它们有优点,测量不影响新合成的或未转化的蛋白质,它或者是不可见的,或继续排放原来的波长。 另外,通过在感兴趣的区域中的反复激发,光学荧光笔可以连续光转换在一个特定的细胞内定位。这种技术是比翻盖更高效,因为,活化蛋白易位可以直接成像。此外,光活化所需要的时间(几秒钟)常常是远小于所需要的时间完全光漂白的类似区域。从改善时间分辨率,调查涉及极其迅速的蜂窝进程将明显受益。
正文完
